Mastzellaktivierung – Histamin ist nicht alles
Inhaltsverzeichnis
Die Mastzelle speichert in ihrem Inneren hunderte von Botenstoffen. Wird sie aktiviert, dann gibt sie diese Mediatoren ins umliegende Gewebe frei. Das führt zu zahlreichen Symptomen und auch dazu, dass weitere Signalketten im Körper aktiviert werden.
Bei Personen mit dauerhaft gesteigerter Mastzellaktivität werden die Zellen viel öfter zur Ausschüttung ihrer Mediatoren angeregt als bei gesunden Menschen. Deshalb ist meist ein dauerhaft erhöhter Spiegel an verschiedenen Mediatoren in Blut oder Urin nachweisbar.
Jeder Körper ist individuell und somit auch die Zusammensetzung der Botenstoffe im Inneren der Mastzellen. Daher können die Symptome und die Therapien bei Betroffenen manchmal unterschiedlich oder sogar komplett gegensätzlich sein.
In diesem Artikel werden die Auswirkungen von 9 Substanzen aus diesem riesigen Mastzell-Mediatorencocktail genauer beleuchtet. Darunter Botenstoffe, die zu Entzündungen und allergischen Reaktionen führen, sowie die Blutgerinnung, die Wundheilung und den Hormonhaushalt beeinflussen.
Histamin
Histamin ist ein Hormon, Neurotransmitter, Allergie- und Entzündungsbotenstoff. Unser Körper benötigt diese Substanz für lebensnotwendige Funktionen.
Das Enzym Histidin-Decarboxylase „HDC“ (Kofaktor: Pyridoxal-5‘-phosphat = aktives Vitamin B6) stellt das biogene Amin aus der Aminosäure L-Histidin her (s. Abbildung 1). Es wird in verschiedenen Zelltypen, wie z.B. den Mastzellen und den Basophilen gespeichert. Diese wiederum schütten das Histamin aus, sobald sie das Signal dafür bekommen.1
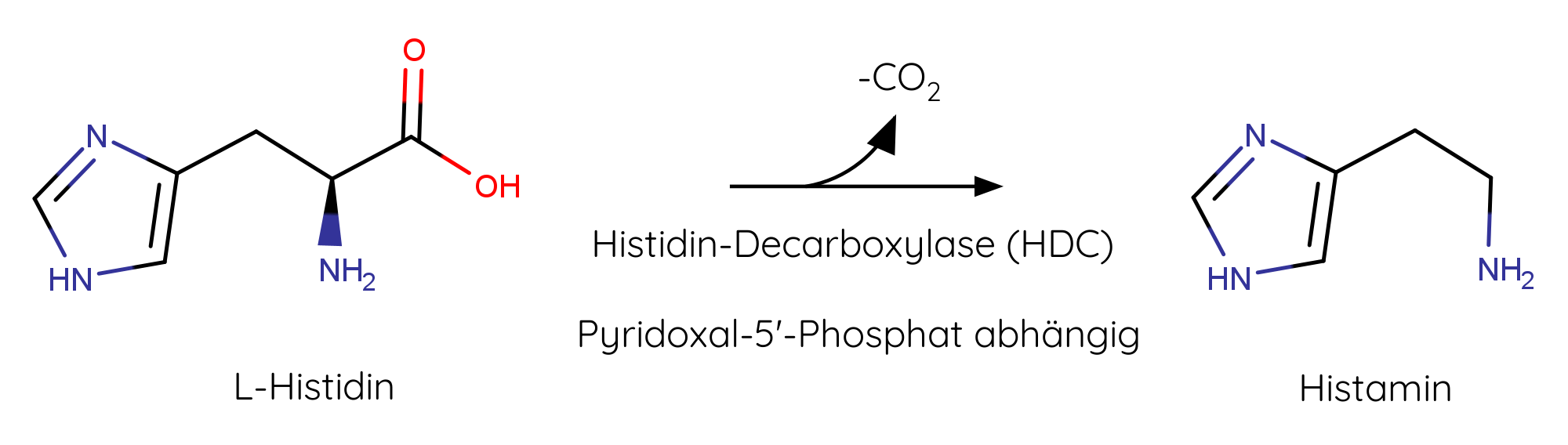
Abb. 1: Histaminsynthese aus der Aminosäure L-Histidin.
Als typischer Allergiebotenstoff ist es Verursacher von Symptomen, wie z.B. Kopfschmerzen, Schwitzen, Flush (Hautrötung), Atemnot, Sehstörungen, Tachykardie, Blutdruckveränderungen, Erbrechen, Durchfall, Angst, uvm.2
Histamin entfaltet seine Wirkung über die Aktivierung der vier Histaminrezeptoren H1 -H4.3
Therapieoptionen
In der Medizin werden bei einem zu hohen Histaminspiegel (Histaminose) Antihistaminika eingesetzt. Detailliertere Informationen zu den vier Histaminrezeptoren und Antihistaminika, kannst du hier nachlesen: „Antihistaminika und die vier Histaminrezeptoren“
Da das Thema “Histamin” sehr umfangreich ist, findest du dazu im separaten Beitrag tiefergreifende Informationen: “Histamin – unser Freund und Feind“.
Heparin
Heparin zählt chemisch zu den Polysacchariden (Mehrfachzuckern), genauer gesagt zu den Glykosaminoglykanen. Dabei handelt es sich um eine Gruppe von Substanzen, die hauptsächlich aus den Bausteinen Glucosamin, Glucuronsäure und Iduronsäure aufgebaut sind. Es wird bei allen Säugetieren in den basophilen Granulozyten und den Mastzellen produziert.
Heparin wirkt gerinnungshemmend und wird daher auch als Medikament in der Thromboseprophylaxe und -therapie eingesetzt. Es zählt zu den Antikoagulantien (Gerinnungshemmern).
Bei einer Mastzelldegranulation können im Akutfall genauso hohe Heparinlevel erreicht werden wie durch subkutan verabreichtes Heparin (sog. Thrombosespritzen; s. Abb.2). Daher kann es bei dauerhaft gesteigerter Mastzellaktivität zu einer erhöhten Blutungsneigung kommen. Diese ist gekennzeichnet durch:
- Blaue Flecken, Hämatombildung
- Verlängerte Blutung (z.B. nach Biopsien)
- Zahnfleischbluten
- Nasenbluten
- Blutungen im Verdauungstrakt
- Menorrhagie (zu lange und zu starke Menstruationsblutung)
Aber: Aufgrund der ebenfalls enthaltenen gerinnungsfördernden Botenstoffe der Mastzelle, kann es bei gesteigerter Mastzellaktivität auch umgekehrt zu einer verstärkten Thromboseneigung kommen.
In beiden Fällen spielt die Mastzellstabilisierung eine entscheidende und wichtige Rolle.
Literaturverzeichnis: 4

Abb. 2: Bei einer akuten Mastzellaktivierung können genauso hohe Heparinlevel erreicht werden, wie durch eine subkutan verabreichte Thrombosespritze.
Plättchenaktivierender Faktor „PAF“
Der plättchenaktivierende Faktor (PAF) zählt zu den Phospholipiden und erhielt seinen Namen aufgrund seiner Eigenschaft die Blutplättchen (Thrombozyten) aktivieren zu können. Bei einer Thrombozytenaktivierung lagern sich die Blutplättchen zusammen und verschließen z.B. verletzte Gefäße. Der Fachbegriff dafür lautet: Thrombozytenaggregation.
PAF wird von verschiedenen Zelltypen ausgeschüttet:
- Mastzellen
- Basophilen
- Neutrophilen
- Eosinophilen
- Fibroblasten
- Thrombozyten
- Endothelzellen
- Herzmuskelzellen
Bedeutung von PAF bei erhöhter Mastzellaktivität:
- PAF wird u.a. bei einer allergischen/pseudoallergischen Reaktion ausgeschüttet
- Die Serumkonzentration korreliert mit der Stärke der Anaphylaxie
- Es führt in wenigen Sekunden zur Ausschüttung von Histamin aus Mastzellen
- PAF verstärkt die Gefäßdurchlässigkeit (Urtikaria, Ödeme) und Bronchokonstriktion (Asthma)
- Reduziert die koronare Durchblutung und senkt die Kontraktion des Herzmuskels
- Direkter Effekt auf die Regelmäßigkeit des Herzschlags (Herzrhythmusstörungen)
- Bildung von Gefäßverschlüssen (Thrombosen)
- Stimulation von Eosinophilen und Neutrophilen
PAF wird durch die PAF-Acetylhydrolasen (PAF-AHs) abgebaut. Die Aktivität dieser Enzyme wurden bei Personen mit hoher allergischer Aktivität teilweise vermindert nachgewiesen.
Therapieoptionen
Das H1-Antihistaminikum Rupatadin verfügt zusätzlich über die Fähigkeit PAF zu hemmen.
Literaturverzeichnis: 5-7
Serotonin „5-HT“
Serotonin, oder auch 5-Hydroxytryptamin (5-HT), zirkuliert im Körper zum größten Teil als Hormon im peripheren Blut. Zu einer geringeren Menge fungiert es als Neurotransmitter im Gehirn. 5-HT kann die Blut-Hirn-Schranke nicht überqueren, daher sind diese beiden Wirkungsorte des Serotonins getrennt. 5-HT ist einer der wichtigsten Signalbotenstoffe zwischen Immunsystem und Nervensystem.
Peripheres Serotonin wird im Darm aus der Aminosäure L-Tryptophan gebildet und zählt zu den biogenen Aminen.
Es kann in der Peripherie von verschiedenen Zelltypen gespeichert und wieder freigegeben werden, darunter z.B. Mastzellen, Thrombozyten und Makrophagen.
Im Blut ist 5-HT an Thrombozyten gebunden und wird durch den PAF von diesen wieder freigegeben. Bei einer Mastzelldegranulation werden also Serotonin und PAF ausgeschüttet. Der PAF führt dann über die Aktivierung der Thrombozyten zu einer weiteren Serotoninausschüttung.
Symptome einer zu hohen Serotoninkonzentration in der Peripherie:
- Übelkeit, Erbrechen (Emesis)
- Erhöhung der Gefäßdurchlässigkeit (Asthma, Ödeme)
- Einfluss auf Darmmotilität (Durchfall, Verstopfung)
- Regelung der Durchlässigkeit der Blut-Hirn-Schranke für z.B. Zytokine (neurologische Effekte)
- Hemmung der Insulinausschüttung und Erhöhung der Gluconeogenese (erhöhter Blutzuckerspiegel)
- Ist ein Entzündungsbotenstoff mit Einfluss auf die Zytokinausschüttung (IL-6, IL-8/CXCL8, IL-12p40, Prostaglandin E2)
- Aktivierung von Immunzellen

Abb. 3: Peripheres Serotonin hat großen Einfluss auf die Darmmotilität, was sich z.B. durch Durchfall zeigen kann.
5-HT besitzt aber auch anti-entzündliche Effekte und kann die Ausschüttung von IL-1beta und TNF-alpha unterdrücken.
Mastzellen sind auch in der Lage durch bestimmte Auslöser ganz gezielt nur Serotonin auszuschütten. Liganden, die zu einer selektiven 5-HT-Ausschüttung führen sind:
- Progesteron
- Neuropeptide, die durch Stress freigegeben werden
Therapieoptionen
- Mastzellstabilisierung
- 5-HT3-Rezeptor-Inhibitoren (z.B. Ondansetron)
Schwangerschaftsübelkeit
5-HT hat signifikanten Einfluss auf die Entstehung von Hyperemesis gravidarum.
Abbau & Nachweis
Das biogene Amin wird über die Enzyme MAO (Monoaminooxidase) und ALDH (Aldehyd-Dehydrogenase) zu 5-Hydroxyindolessigsäure (5-HIES) abgebaut.
Der Nachweis von 5-HIES ist über einen Urintest möglich.
Literaturverzeichnis: 8-16
beta-Tryptase
Die Tryptasen zählen zu den Proteasen. Das sind Enzyme, die Proteine spalten.
Es existieren vier Formen der Tryptase: alpha, beta, gamma, delta.
Die beta-Tryptase ist die Form, die überwiegend nur in Mastzellen vorliegt. Genau aus diesem Grund wird die (beta) Tryptasebestimmung oft als alleiniger Marker für eine erhöhte Mastzellaktivität herangezogen, ohne dass dabei die zahlreichen anderen Botenstoffe berücksichtigt werden.
Die Tryptasemenge in Mastzellen ändert sich ständig. Dies ist abhängig von dem Verhältnis zwischen der Biosynthese und der Ausschüttung oder auch vom Reifungsgrad der Mastzelle.
Tryptase steht im Zusammenhang mit:
- Erhöhter Immunantwort
- Verstärktem Allergiegeschehen
- Gesteigerter Entzündung
- Neugestaltung von Gewebestrukturen
- Schutz vor bakteriellen Lungenentzündungen
Mastzellen findet man aufgrund ihrer Beteiligung an der Wundheilung gehäuft in Wunden und Narben (s. Abbildung 4). Vorallem die Tryptase ist in diesen Geweben stark exprimiert. Übermäßige postoperative Verwachsungen im Bauchraum können mit erhöhter Mastzellaktivität in Verbindung stehen.
Abb. 4: Die Mastzelltryptase ist an der Wundheilung und Narbenbildung beteiligt.
Endometriose und Mastzellen
Bei Patientinnen mit Endometriose ist die Anzahl der Tryptase-positiven Zellen in der Flüssigkeit der Bauchhöhle deutlich erhöht. Aus diesem Grund kann auch bei Endometriose ein Zusammenhang zu einer gesteigerten Mastzellaktivität bestehen.
Literaturverzeichnis: 17-21
Schilddrüsenhormone
Weitere Substanzen, die ebenfalls in Mastzellen gespeichert vorliegen, sind das Schilddrüsenhormon Trijodthyronin „T3“ und seine Metaboliten 3,5-Dijodthyronin (T2), 3-Jodthyronamin (T1AM) und 3-Jodthyroessigsäure (TA1).
T3, TA1 und T1AM aus der Mastzelle führen zu neuroprotektiven Effekten, aber auch zu Juckreiz und Entzündung. In Studien mit Nagetieren führen sie unter Histaminbeteiligung zu verstärktem Schmerzempfinden.
Abb. 5 Mastzellen und die Schilddrüse (SD) beeinflussen sich gegenseitig. Um die Zusammenhänge besser zu verstehen, wird noch viel Forschungsarbeit benötigt.
Einige Erkenntnisse sind bisher:
- T3 und seine Metaboliten werden bei einer Mastzelldegranulation ausgeschüttet, was z.B. zu Juckreiz führen kann.
- Mastzellen besitzen Rezeptoren für T3 und TSH
- In einer Studie an Ratten, denen T3 gegeben wurde, stiegen die Histaminkonzentrationen in Hypothalamus, Thalamus und Großhirnrinde an
- Die Zahl der Gewebemastzellen und der Mastzellen in der SD steigt bei einer Schilddrüsenunterfunktion an. Die Vermutung der Forscher ist, dass die Mastzellen die SD mit Schilddrüsenhormonen unterstützen könnten
- Bei Patienten mit Urtikaria und Angioödemen wurden in einer Studie Autoantikörper gegen die Thyreoperoxidase (TPO) festgestellt. Diese Antikörper können die Mastzellen aktivieren und so eine aktive Rolle in der Pathogenese der Urtikaria spielen
Hashimoto Thyreoiditis & Mastzellen
Aufgrund des Einflusses von Schilddrüsenantikörper, besteht auch ein Zusammenhang zwischen SD-Autoimmunerkrankungen, wie Hashimoto Thyreoiditis, und gesteigerter Mastzellaktivität.
Literaturverzeichnis: 22
Die Schilddrüse und Mastzellen beeinflussen sich gegenseitig. Schau dir dazu unser Video an.
Tumornekrosefaktor alpha „TNF alpha„
Der Tumornekrosefaktor alpha, auch „TNF alpha“ genannt, gehört zu der Gruppe der Zytokine. Diese Substanz wird z.B. von Mastzellen und Makrophagen ausgeschüttet.
Eigenschaften von TNF alpha:
- Früher Entzündungsmarker, fördert die Produktion von Akut-Phase-Proteinen, wie CRP
- Fieber
- Resistenz gegen Tumore, kann die Zellapoptose (Zelltod) anregen
- Infektionsabwehr, z.B. gegen Tuberkulose-Erreger
- Zentrale pro-entzündliche Rolle bei Colitis, Sepsis und Autoimmunerkrankungen
- Verstärkt Insulinresistenz
- Kann über einen längeren Zeitraum zu Kachexie führen
Anti-TNF-Therapie
TNF-alpha-Blocker werden bislang v.a. erfolgreich bei der Behandlung von Morbus Crohn, Colitis Ulcerosa, rheumatoider Arthritis und Psoriasis-Arthritis eingesetzt. Dabei handelt es sich um Biologika, wie Infliximab, Adalimumab, Golimumab und Certolizumab Pegol.
Literaturverzeichnis: 23-26
Prostaglandine „PG„
Prostaglandine (PG) zählen zu den Eicosanoiden und wirken im Körper als Gewebshormone. Sie werden u.a. auch in der Mastzelle nach ihrer Aktivierung gebildet und dadurch zeitverzögert ausgeschüttet.
Man unterscheidet Prostaglandine in Form von Serientypen:
- PG der Serie 1: Synthese aus der Omega 6 Fettsäure „Dihomogammalinolensäure“ (DGLA); Beispiele: PGA1, PGE1
Eigenschaften: Entzündungshemmend, gerinnungshemmend.
- PG der Serie 2: Synthese aus der Omega 6 Fettsäure „Arachidonsäure“ (AA); Beispiele: PGD2, PGE2, PGF2alpha
Eigenschaften: Entzündungsfördernd, verstärken die Schmerzwahrnehmung, verengen Blutgefäße, verstärken Blutgerinnung
- PG der Serie 3: Synthese aus der Omega 3 Fettsäure „Eicosapentaensäure“ (EPA); Beispiele: PGD3, PGE3
Eigenschaften: Entzündungshemmend, senken Blutgerinnung
Synthese von PG
Alle PGs werden u.a. über das COX1-Enzym aus den unerschiedlichen Fettsäuren gebildet. Aus DGLA kann auch AA entstehen.
Wie kann man die COX1-Enzyme beeinflussen?
- Anti-entzündliche Fettsäuren:
Durch die Aufnahme von Omega 3 Fettsäuren (z.B. alpha-Linolensäure, EPA), kann die Produktion von anti-entzündlichen PGs gesteigert werden.
- COX1-Hemmer:
Durch die Hemmung des COX-Enzyms wird die PG-Produktion heruntergefahren.
Phytonährstoffe: Polyphenole, wie z.B. Curcumin, Resveratrol
Medikamente: Acetylsalicylsäure (Aspirin), Ibuprofen (s. Abbildung 6)
- Cortison:
Corticosteroide hemmen das Enzym Phospholipase A2, das AA aus Zellwänden herauslöst (s. Abbildung 7). Dadurch steht weniger AA für die COX-Enzyme zur Verfügung und weniger PG der Serie 2 können gebildet werden. Das ist in der medikamentösen Therapie beliebt, allerdings auch mit vielen Nebenwirkungen verbunden.
Literaturverzeichnis: 14,27-31
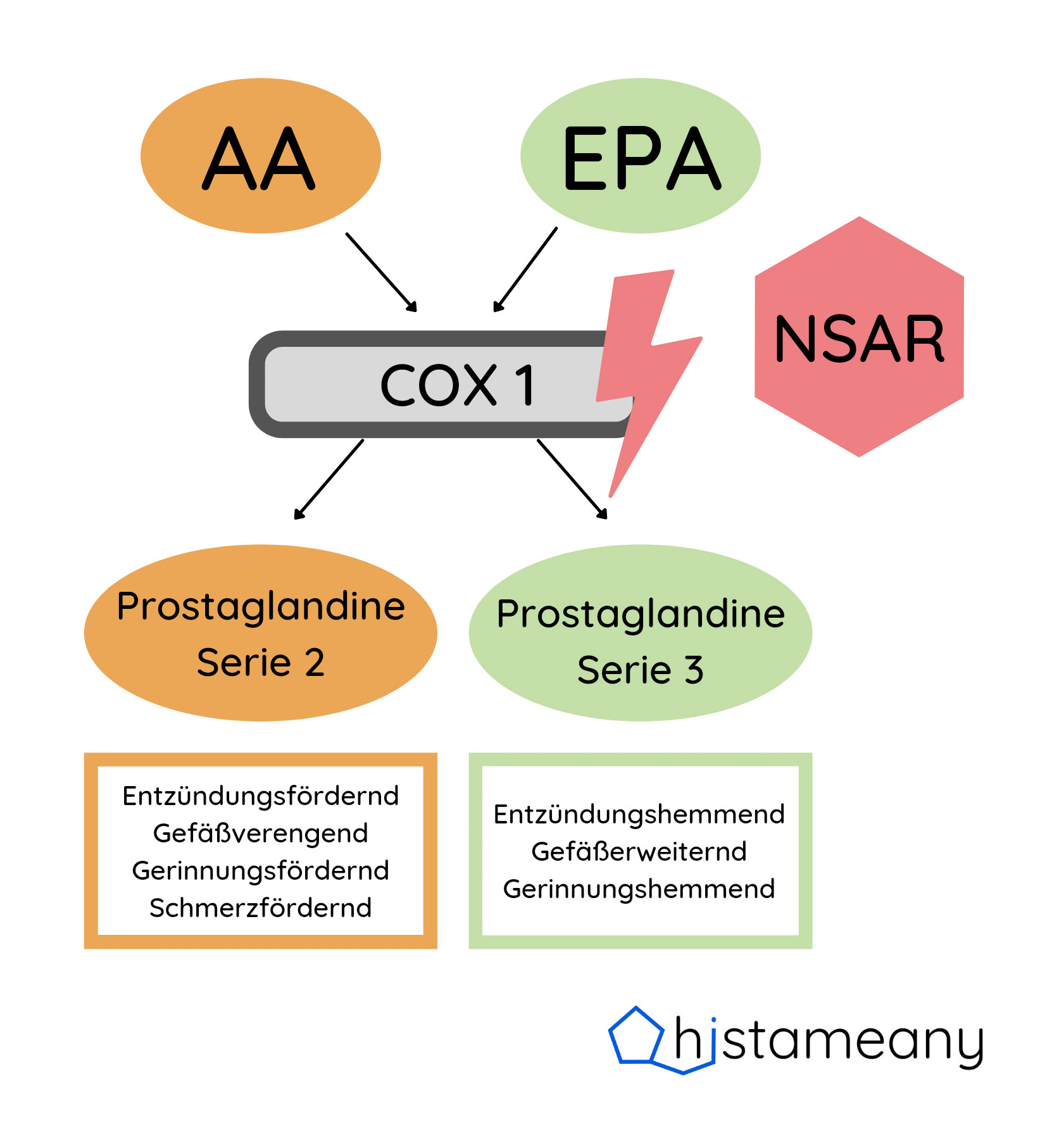
Abb. 6: Pharmakologische Wirkstoffe wie Aspirin und Ibuprofen (NSAR) reduzieren die Prostaglandinbildung über die Hemmung des COX-1-Enzyms.
Vorsicht bei Salicylatintoleranz
Hier besteht eine Störung im Eicosanoidstoffwechsel. Durch die COX1-Hemmung kann es bei diesem Krankheitsbild zu schweren und teilweise lebensbedrohlichen pseudoallergischen Reaktionen kommen!
Hier erklären wir dir die Störung im Eicosanoidstoffwechsel bei einer Salicylatintoleranz: „Die Ursachen der Salicylatintoleranz Teil 1/3: COX und LOX„
Leukotriene „LT„
Eine weitere Substanzklasse aus der Gruppe der Eicosanoide sind die Leukotriene (LT). Sie werden am Enzym 5-Lipoxygenase (LOX) gebildet und (wie PG) in Serientypen eingeteilt.
Entscheidend ist auch hier wieder die Fettsäure aus der sie gebildet werden.
- LT der Serie 4: Synthese aus Arachidonsäure (AA; Omega 6); Beispiele: LTB4, LTC4
Bei allergischen und entzündlichen Erkrankungen erhöht
- LT der Serie 5: Synthese aus Eicosapentaensäure (EPA; Omega 3); Beispiele: LTE5
Eigenschaften: Antientzündlich.
Wie kann man die LOX-Enzyme beeinflussen?
- Omega 3 Fettsäuren
Durch die Aufnahme von Omega 3 Fettsäuren (z.B. alpha-Linolensäure, EPA), kann die Produktion von anti-entzündlichen LTs gesteigert werden.
- LOX-Inhibitoren
Es gibt sekundäre Pflanzenstoffe, die in der Lage sind LOX zu hemmen. Dazu zählen u.a. Curcumin und ein Bestandteil von Weihrauch. (Achtung, schlechte Verträglichkeit bei Salicylatintoleranz.)
Das einzige LOX-hemmende Medikament „Zileuton“ ist nur in den USA zugelassen.
- Leukotrien-Antagonist
Leukotrien-Antagonisten blockieren die LT-Rezeptoren, sodass LTs ihre Wirkung nicht entfalten können.
Medikamente: Montelukast (s. Abbildung 7), Zafirlukast (nur über internationale Apotheke)
- Cortison
Corticosteroide hemmen das Enzym Phospholipase A2, das Arachidonsäure aus Zellwänden herausgelöst (s. Abbildung 7). Durch die Blockade steht weniger AA für das LOX Enzym zur Verfügung und es werden weniger entzündungsfördernde Leukotriene gebildet.
Literaturverzeichnis: 27,32-36
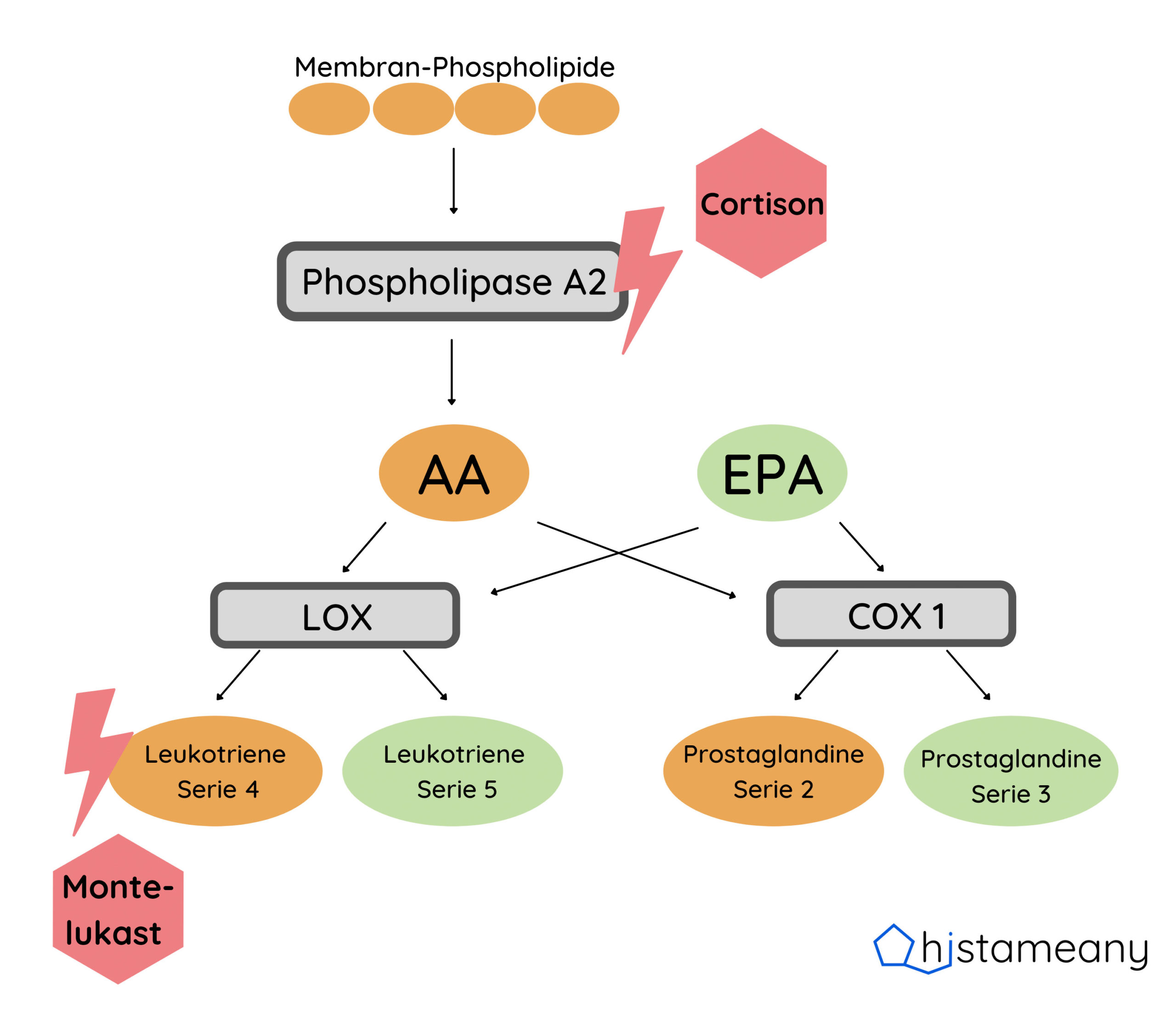
Abb. 7: Einfluss von Cortison und dem Leukotrien-Antagonisten Montelukast auf die Leukotrienbildung und -wirkung.
Disclaimer
Die Inhalte dieses Beitrags sind keine Therapie- oder Medikamentenempfehlung. Die Informationen dienen lediglich der Aufklärung. Jegliche Veränderung der Therapie ist mit dem behandelnden Arzt zu besprechen.
Du wirst als Erstes informiert, wenn wir neue Produkte haben, es neue Artikel im Science Blog gibt oder wenn eine Rabattaktion stattfindet.
Literaturverzeichnis
1. Mehta PK, Christen P. The molecular evolution of pyridoxal-5’-phosphate-dependent enzymes. Adv Enzymol Relat Areas Mol Biol. 2000;74:129-184. doi:10.1002/9780470123201.ch4
2. Naranjo P. Toxicity of Histamine: Lethal Doses. In: Rocha e Silva M, ed. Histamine and Anti-Histaminics. Springer Berlin Heidelberg; 1966:179-201. doi:10.1007/978-3-662-12016-3_9
3. Tiligada E, Ennis M. Histamine pharmacology: from Sir Henry Dale to the 21st century: Histamine pharmacology. Br J Pharmacol. Published online December 2, 2018. doi:10.1111/bph.14524
4. Seidel H, Hertfelder HJ, Oldenburg J, Kruppenbacher JP, Afrin LB, Molderings GJ. Effects of Primary Mast Cell Disease on Hemostasis and Erythropoiesis. Int J Mol Sci. 2021;22(16):8960. doi:10.3390/ijms22168960
5. Pałgan K, Bartuzi Z. Platelet activating factor in allergies. Int J Immunopathol Pharmacol. 2015;28(4):584-589. doi:10.1177/0394632015600598
6. Zimmerman GA, McIntyre TM, Prescott SM, Stafforini DM. The platelet-activating factor signaling system and its regulators in syndromes of inflammation and thrombosis. Crit Care Med. 2002;30(5 Suppl):S294-301. doi:10.1097/00003246-200205001-00020
7. Kajiwara N, Sasaki T, Bradding P, et al. Activation of human mast cells through the platelet-activating factor receptor. J Allergy Clin Immunol. 2010;125(5):1137-1145.e6. doi:10.1016/j.jaci.2010.01.056
8. Herr N, Bode C, Duerschmied D. The Effects of Serotonin in Immune Cells. Front Cardiovasc Med. 2017;4. Accessed May 4, 2022.
9. Conti P, Shaik-Dasthagirisaheb YB. Mast Cell Serotonin Immunoregulatory Effects Impacting on Neuronal Function: Implications for Neurodegenerative and Psychiatric Disorders. Neurotox Res. 2015;28(2):147-153. doi:10.1007/s12640-015-9533-0
10. Höglund E, Øverli Ø, Winberg S. Tryptophan Metabolic Pathways and Brain Serotonergic Activity: A Comparative Review. Front Endocrinol. 2019;10. doi:10.3389/fendo.2019.00158
11. Vliagoftis H, Dimitriadou V, Theoharides TC. Progesterone Triggers Selective Mast Cell Secretion of 5-Hydroxytryptamine. Int Arch Allergy Immunol. 1990;93(2-3):113-119. doi:10.1159/000235289
12. Fujiwara-Sawada M, Imanishi T, Yoshida A, Baba J. Possible involvement of peripheral serotonin 5-HT3 receptors in fluvoxamine-induced emesis in Suncus murinus. J Pharm Pharmacol. 2003;55(2):271-274. doi:10.1211/002235702496
13. Minami M, Endo T, Hirafuji M. [Role of serotonin in emesis]. Nihon Yakurigaku Zasshi Folia Pharmacol Jpn. 1996;108(5):233-242. doi:10.1254/fpj.108.233
14. Molderings GJ, Haenisch B, Brettner S, et al. Pharmacological treatment options for mast cell activation disease. Naunyn Schmiedebergs Arch Pharmacol. 2016;389:671-694. doi:10.1007/s00210-016-1247-1
15. Martin AM, Young RL, Leong L, et al. The Diverse Metabolic Roles of Peripheral Serotonin. Endocrinology. 2017;158(5):1049-1063. doi:10.1210/en.2016-1839
16. Plasma serotonin levels are elevated in pregnant women with hyperemesis gravidarum. springermedizin.de. Accessed May 4, 2022. https://www.springermedizin.de/plasma-serotonin-levels-are-elevated-in-pregnant-women-with-hype/8426676
17. Atiakshin D, Buchwalow I, Samoilova V, Tiemann M. Tryptase as a polyfunctional component of mast cells. Histochem Cell Biol. 2018;149(5):461-477. doi:10.1007/s00418-018-1659-8
18. Gao F, Zhao Y, Feng Y qiang, et al. [Expression of mast cell tryptase in scar]. Zhonghua Zheng Xing Wai Ke Za Zhi Zhonghua Zhengxing Waike Zazhi Chin J Plast Surg. 2010;26(2):132-135.
19. Borelli V, Martinelli M, Luppi S, et al. Mast Cells in Peritoneal Fluid From Women With Endometriosis and Their Possible Role in Modulating Sperm Function. Front Physiol. 2020;10:1543. doi:10.3389/fphys.2019.01543
20. Liebman SM, Langer JC, Marshall JS, Collins SM. Role of mast cells in peritoneal adhesion formation. Am J Surg. 1993;165(1):127-130. doi:10.1016/s0002-9610(05)80415-5
21. Caughey GH. Mast cell proteases as protective and inflammatory mediators. Adv Exp Med Biol. 2011;716:212-234. doi:10.1007/978-1-4419-9533-9_12
22. Landucci E, Laurino A, Cinci L, Gencarelli M, Raimondi L. Thyroid Hormone, Thyroid Hormone Metabolites and Mast Cells: A Less Explored Issue. Front Cell Neurosci. 2019;13. doi:10.3389/fncel.2019.00079
23. Hotamisligil GS. Mechanisms of TNF-alpha-induced insulin resistance. Exp Clin Endocrinol Diabetes Off J Ger Soc Endocrinol Ger Diabetes Assoc. 1999;107(2):119-125. doi:10.1055/s-0029-1212086
24. Hehlgans T, Pfeffer K. The intriguing biology of the tumour necrosis factor/tumour necrosis factor receptor superfamily: players, rules and the games. Immunology. 2005;115(1):1. doi:10.1111/j.1365-2567.2005.02143.x
25. Meijer C, Huysen V, Smeenk RT, Swaak AJ. Profiles of cytokines (TNF alpha and IL-6) and acute phase proteins (CRP and alpha 1AG) related to the disease course in patients with systemic lupus erythematosus. Lupus. 1993;2(6):359-365. doi:10.1177/096120339300200605
26. Peyrin-Biroulet L, Sandborn WJ, Panaccione R, et al. Tumour necrosis factor inhibitors in inflammatory bowel disease: the story continues. Ther Adv Gastroenterol. 2021;14:17562848211059954. doi:10.1177/17562848211059954
27. Otohinoyi D, Morebise O, Fakoya A. Mechanism of Inflammatory Pain and Implementation of Natural Products as Rescue Route. J Pharm Biomed Anal. 2016;6:320-359. doi:10.20936/jpbms/160252
28. Wang X, Lin H, Gu Y. Multiple roles of dihomo-γ-linolenic acid against proliferation diseases. Lipids Health Dis. 2012;11:25. doi:10.1186/1476-511X-11-25
29. Yao C, Narumiya S. Prostaglandin‐cytokine crosstalk in chronic inflammation. Br J Pharmacol. 2019;176(3):337. doi:10.1111/bph.14530
30. Bagga D, Wang L, Farias-Eisner R, Glaspy JA, Reddy ST. Differential effects of prostaglandin derived from ω-6 and ω-3 polyunsaturated fatty acids on COX-2 expression and IL-6 secretion. Proc Natl Acad Sci. 2003;100(4):1751-1756. doi:10.1073/pnas.0334211100
31. Szewczuk LM, Forti L, Stivala LA, Penning TM. Resveratrol is a peroxidase-mediated inactivator of COX-1 but not COX-2: a mechanistic approach to the design of COX-1 selective agents. J Biol Chem. 2004;279(21):22727-22737. doi:10.1074/jbc.M314302200
32. Molderings GJ, Baenkler HW Dustri Verlag Dr Karl Feistle. Salicylat-Intoleranz, Pseudo-Allergien, Mastozytose.; 2022.
33. Whelan J, Broughton KS, Kinsella JE. The comparative effects of dietary α-linolenic acid and fish oil on 4- and 5-series leukotriene formationin vivo. Lipids. 1991;26(2):119-126. doi:10.1007/BF02544005
34. Safayhi H, Mack T, Sabieraj J, Anazodo MI, Subramanian LR, Ammon HP. Boswellic acids: novel, specific, nonredox inhibitors of 5-lipoxygenase. J Pharmacol Exp Ther. 1992;261(3):1143-1146.
35. Hong J. Modulation of arachidonic acid metabolism by curcumin and related -diketone derivatives: effects on cytosolic phospholipase A2, cyclooxygenases and 5-lipoxygenase. Carcinogenesis. 2004;25(9):1671-1679. doi:10.1093/carcin/bgh165
36. Schweizer S, von Brocke AFW, Boden SE, Bayer E, Ammon HPT, Safayhi H. Workup-Dependent Formation of 5-Lipoxygenase Inhibitory Boswellic Acid Analogues. J Nat Prod. 2000;63(8):1058-1061. doi:10.1021/np000069k
Kommentare
Füge einen Kommentar hinzu
Du musst angemeldet sein, um einen Kommentar abzugeben.
Sie müssen den Inhalt von reCAPTCHA laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr InformationenSie müssen den Inhalt von Turnstile laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr InformationenSie müssen den Inhalt von reCAPTCHA laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr InformationenSie sehen gerade einen Platzhalterinhalt von Facebook. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenSie sehen gerade einen Platzhalterinhalt von Instagram. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenUm den Inhalt von TrustIndex zu sehen, bitte unten klicken. Dabei werden Daten an Drittanbieter übermittelt.
Weitere InformationenSie sehen gerade einen Platzhalterinhalt von X. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr Informationen

super artikel! danke